Fenyloketonuria
Co to jest ?
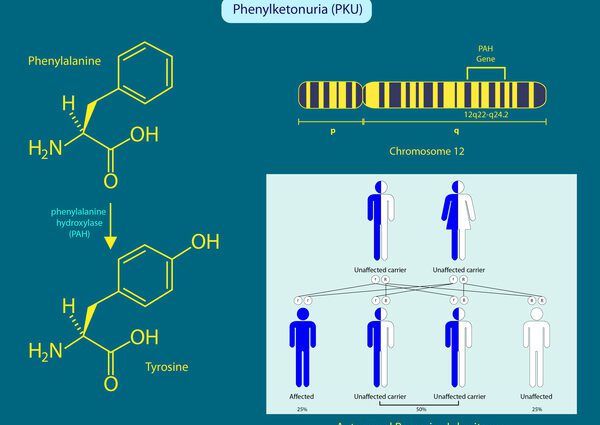
Fenyloketonuria jest chorobą charakteryzującą się brakiem asymilacji (lub metabolizmem) fenyloalaniny.
Fenyloalanina jest niezbędnym aminokwasem pełniącym fundamentalną rolę w układzie nerwowym poprzez stymulację tarczycy. Jest także stymulantem intelektualnym. Aminokwas ten nie jest syntetyzowany przez organizm i dlatego musi być dostarczany by jedzenie. Rzeczywiście, fenyloalanina jest jednym ze składników wszystkich produktów spożywczych bogatych w białka pochodzenia zwierzęcego i roślinnego: mięsa, ryb, jaj, soi, mleka, sera itp.
Jest to rzadka choroba genetyczna i dziedziczna, która dotyka zarówno dziewcząt, jak i chłopców, bez szczególnej przewagi.
Jeśli choroba nie zostanie wykryta bardzo wcześnie w celu szybkiego leczenia, może dojść do nagromadzenia tej substancji w organizmie, a zwłaszcza w układzie nerwowym. Zbyt dużo fenyloalaniny w rozwijającym się mózgu jest toksyczne.
Nadmiar fenyloalaniny obecny w organizmie jest usuwany przez układ nerkowy i dlatego znajduje się w moczu pacjenta w postaci fenyloketonów. (2)
We Francji test przesiewowy na obecność fenyloalaniny jest przeprowadzany systematycznie po urodzeniu: test Guthrie.
Częstość występowania (liczba osób z chorobą w populacji w danym czasie) zależy od kraju i może wahać się od 1/25 do 000/1.
We Francji częstość występowania fenyloketonurii wynosi 1/17. (000)
Choroba ta jest leczona dietą ubogą w białko w celu obniżenia poziomu fenyloalaniny w organizmie pacjenta i ograniczenia uszkodzenia mózgu.
Wczesne leczenie choroby zwykle zapobiega rozwojowi objawów.
Ponadto późne leczenie prowadzące do akumulacji tej cząsteczki w mózgu ma szczególne konsekwencje: (3)
– trudności w nauce;
– zaburzenia zachowania;
– zaburzenia padaczkowe;
– egzema.
W badaniach krwi po urodzeniu wykazano trzy postacie choroby: (2)
– typowa fenyloketonuria: z fenyloalaninemią (poziom fenyloalaniny we krwi) powyżej 20 mg/dl (lub 1 μmol/l);
– atypowa fenyloketonuria: na poziomie od 10 do 20 mg/dl (lub 600-1 µmol/l);
– Trwała umiarkowana hiperfenyloalaninemia (HMP), w której fenyloalaninemia jest mniejsza niż 10 mg/dl (lub 600 μmol/l). Ta postać choroby nie jest poważna i wymaga jedynie prostego monitorowania w celu uniknięcia pogorszenia.
objawy
Systematyczne badania przesiewowe po urodzeniu pozwalają w większości przypadków ograniczyć pojawianie się typowych objawów choroby.
Leczenie choroby opiera się na diecie ubogiej w białko, a monitorowanie fenyloalaniny również pomaga zapobiegać gromadzeniu się fenyloalaniny w organizmie, a zwłaszcza w mózgu. (2)
W przypadku braku diagnozy noworodka objawy fenyloketonurii pojawiają się szybko po urodzeniu i mogą być mniej lub bardziej nasilone w zależności od postaci choroby.
Objawy te charakteryzują:
– opóźnienie rozwoju umysłowego dziecka;
– opóźnienie wzrostu;
– małogłowie (nieprawidłowo mały rozmiar czaszki);
– konwulsje i drżenie;
– egzema;
– wymioty ;
– zaburzenia zachowania (nadpobudliwość);
– zaburzenia motoryczne.
W przypadku hiperfenyloalaniny, możliwe są mutacje w genie kodującym kofaktor konwersji fenyloalaniny do tyrozyny (kofaktor BHA). Te zaburzenia w produkcji tyrozyny prowadzą do:
– jasna karnacja;
- jasne włosy.
Początki choroby
Fenyloalanina jest dziedziczną chorobą genetyczną. Powoduje to dziedziczenie autosomalne recesywne. Ten sposób transmisji dotyczy autosomu (chromosomów niepłciowych), a recesywność powoduje konieczność posiadania przez osobnika dwóch kopii zmutowanego allelu w celu rozwinięcia chorego fenotypu. (4)
Przyczyną choroby jest mutacja genu PAH (12q22-q24.2). Gen ten koduje enzym umożliwiający hydrolizę (zniszczenie substancji przez wodę): hydroksylazę fenyloalaniny.
Zmutowany gen powoduje zatem zmniejszenie aktywności hydroksylazy fenyloalaniny, a zatem fenyloalanina z pożywienia nie jest efektywnie przetwarzana przez organizm. Poziom tego aminokwasu we krwi chorego osobnika jest zatem podwyższony. Wraz ze wzrostem tej ilości fenyloalaniny w organizmie, jej magazynowanie będzie następowało w różnych narządach i/lub tkankach, szczególnie w mózgu. (4)
Inne mutacje zostały wykazane w związku z chorobą. Są to modyfikacje na poziomie genów kodujących BHA (kofaktor konwersji fenyloalaniny do tyrozyny) i dotyczą w szczególności postaci hiperfenyloalaniny. (1)
Czynniki ryzyka
Czynniki ryzyka związane z chorobą mają podłoże genetyczne. W rzeczywistości przeniesienie tej choroby następuje poprzez przeniesienie autosomalne recesywne. Albo, że obecność dwóch alleli zmutowanych dla genu musi być obecna u osobnika, aby rozwinęła się choroba.
W tym sensie każdy rodzic chorego osobnika musi mieć kopię zmutowanego genu. Ponieważ jest to forma recesywna, rodzice z tylko jedną kopią zmutowanego genu nie wykazują objawów choroby. Niemniej jednak są one wymagane, do 50% każdy, aby każdy przekazał zmutowany gen potomstwu. Jeśli ojciec i matka dziecka przekażą zmutowany gen, osobnik będzie miał dwa zmutowane allele i rozwinie chory fenotyp. (4)
Zapobieganie i leczenie
Rozpoznanie fenyloketonurii odbywa się głównie poprzez program badań przesiewowych urodzeń: systematyczne badania przesiewowe noworodków. To jest test Guthrie.
Test ten uważa się za pozytywny, jeśli poziom fenyloalaniny we krwi jest wyższy niż 3 mg/dl (lub 180 µmol/l). W przypadku nadmiernej fenyloalaninemii w specjalistycznym ośrodku wykonuje się powtórne badanie krwi w celu potwierdzenia lub nie obecności fenyloketonurii. Jeżeli poziom fenyloalaniny jest nadal wyższy niż 3 mg/dl podczas drugiej dawki i nie zidentyfikowano żadnej innej potencjalnie odpowiedzialnej choroby, wówczas stawia się diagnozę. (2)
Diagnozę tej choroby należy odróżnić od diagnozy niedoboru BH4. W rzeczywistości to ostatnie jest szczególnie charakterystyczne dla hiperfenyloalaniny i wymaga jedynie prostego monitorowania. Natomiast wykrycie obecności fenyloketonurii u osobnika wymaga specjalnego leczenia i diety niskobiałkowej. (1)
Podstawowym sposobem leczenia fenyloketonurii jest zatem dieta uboga w fenyloalaninę, tj. zmniejszenie spożycia białka w diecie. Ta niskobiałkowa dieta musi zostać wdrożona zaraz po przeprowadzeniu badań przesiewowych noworodków. Musi być przestrzegana przez całe życie i może być mniej lub bardziej rygorystyczna w zależności od przedmiotu i postaci choroby. (2)
Oprócz diety zubożonej w fenyloalaninę pacjentowi można przepisać dichlorowodorek sapropteryny, aby jego dieta była mniej rygorystyczna, a nawet aby dieta pozostała normalna. (2)
Ponadto można zalecić suplementy diety bogate w aminokwasy (z wyjątkiem fenyloalaniny), witaminy i minerały w celu przywrócenia równowagi w tych podażach wynikających z tej diety. (3)
Osoby z fenyloketonurią powinny bezwzględnie unikać spożywania aspartamu (sztucznego słodzika stosowanego w wielu produktach, takich jak napoje przemysłowe, przetwory spożywcze itp.). W rzeczywistości po wchłonięciu aspartam jest przekształcany w organizmie w fenyloalaninę. W tym sensie zwiększa ryzyko akumulacji tej cząsteczki w organizmie i stwarza ryzyko toksycznego dla chorego osobnika. Aspartam jest również obecny w wielu lekach, szczególna uwaga pacjentów jest wymagana podczas przyjmowania niektórych leków.
W zakresie profilaktyki, ponieważ przeniesienie choroby jest dziedziczne, rodziny dotknięte chorobą mogą uzyskać pomoc i poradę genetyczną.
Rokowanie jest zmienne w zależności od pacjenta i postaci choroby.